Մոլեկուլային-կինետիկ տեսությունը թույլ է տալիս, վերլուծելով համակարգի մանրադիտակային վարքագիծը և օգտագործելով վիճակագրական մեխանիկայի մեթոդները, ստանալ թերմոդինամիկական համակարգի կարևոր մակրոսկոպիկ բնութագրերը։ Միկրոսկոպիկ բնութագրիչներից մեկը, որը կապված է համակարգի ջերմաստիճանի հետ, գազի մոլեկուլների միջին քառակուսի արագությունն է։ Մենք տալիս ենք դրա բանաձևը և համարում հոդվածում։
Իդեալական գազ
Մենք անմիջապես նշում ենք, որ գազի մոլեկուլների քառակուսային միջին արագության բանաձևը տրվելու է հատուկ իդեալական գազի համար: Դրա տակ ֆիզիկայում համարվում է այնպիսի բազմամասնական համակարգ, որտեղ մասնիկները (ատոմներ, մոլեկուլներ) չեն փոխազդում միմյանց հետ (նրանց կինետիկ էներգիան մեծության մի քանի կարգով գերազանցում է փոխազդեցության պոտենցիալ էներգիան) և չունեն չափումներ, այսինքն՝ դրանք վերջավոր զանգվածով կետեր են (մասնիկների միջև հեռավորությունը մի քանի կարգով մեծ է դրանց չափից։գծային).
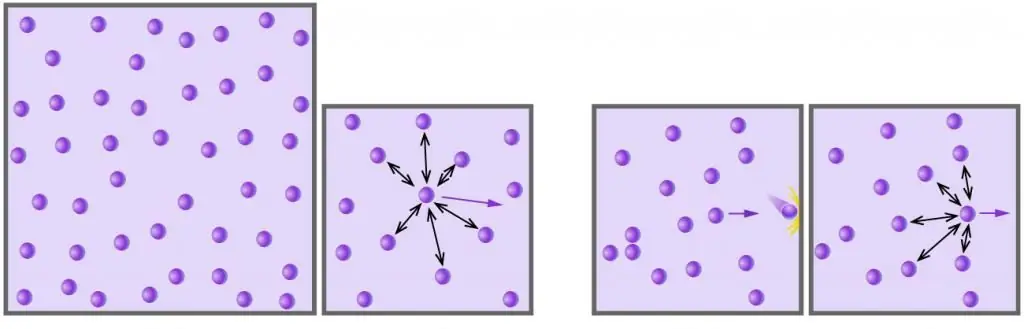
Ցանկացած գազ, որը բաղկացած է քիմիապես չեզոք մոլեկուլներից կամ ատոմներից, և որը գտնվում է ցածր ճնշման տակ և ունի բարձր ջերմաստիճան, կարող է իդեալական համարվել: Օրինակ, օդը իդեալական գազ է, բայց ջրի գոլորշին այլևս այդպիսին չէ (ջրի մոլեկուլների միջև գործում են ուժեղ ջրածնային կապեր):
Մոլեկուլային կինետիկ տեսություն (MKT)

MKT-ի շրջանակներում իդեալական գազ ուսումնասիրելիս պետք է ուշադրություն դարձնել երկու կարևոր գործընթացի.
- Գազը ճնշում է ստեղծում՝ փոխանցելով այն պարունակող անոթի պատերին, իմպուլսը, երբ մոլեկուլներն ու ատոմները բախվում են դրանց: Նման բախումները կատարյալ առաձգական են։
- Գազի մոլեկուլները և ատոմները պատահականորեն շարժվում են բոլոր ուղղություններով տարբեր արագություններով, որոնց բաշխումը համապատասխանում է Մաքսվել-Բոլցմանի վիճակագրությանը: Մասնիկների միջև բախման հավանականությունը չափազանց փոքր է, քանի որ դրանց աննշան չափերը և նրանց միջև մեծ հեռավորությունները:
Չնայած այն փաստին, որ գազի մասնիկների անհատական արագությունները շատ տարբեր են միմյանցից, այս արժեքի միջին արժեքը ժամանակի ընթացքում մնում է հաստատուն, եթե համակարգի վրա արտաքին ազդեցություններ չկան: Գազի մոլեկուլների միջին քառակուսի արագության բանաձևը կարելի է ստանալ՝ դիտարկելով կինետիկ էներգիայի և ջերմաստիճանի հարաբերությունները։ Այս խնդրին կանդրադառնանք հոդվածի հաջորդ պարբերությունում։
Իդեալական գազի մոլեկուլների քառակուսային միջին արագության բանաձևի ստացում
Ֆիզիկայի ընդհանուր դասընթացից յուրաքանչյուր ուսանող գիտի, որ m զանգված ունեցող մարմնի փոխադրական շարժման կինետիկ էներգիան հաշվարկվում է հետևյալ կերպ.
Ek=mv2/2
Որտեղ v-ն գծային արագությունն է: Մյուս կողմից, մասնիկի կինետիկ էներգիան կարող է որոշվել նաև T բացարձակ ջերմաստիճանով, օգտագործելով փոխակերպման գործակիցը kB (Բոլցմանի հաստատուն): Քանի որ մեր տարածությունը եռաչափ է, Ek հաշվարկվում է հետևյալ կերպ.
Ek=3/2kBT.
Համարժեք է երկու հավասարություններին և դրանցից արտահայտելով v, մենք ստանում ենք քառակուսի իդեալական գազի միջին արագության բանաձևը՝
mv2/2=3/2kBT=>
v=√(3kBT/m).
Այս բանաձևում m - գազի մասնիկի զանգվածն է: Դրա արժեքը անհարմար է գործնական հաշվարկներում օգտագործելու համար, քանի որ այն փոքր է (≈ 10-27կգ): Այս անհարմարությունից խուսափելու համար հիշենք գազի համընդհանուր R հաստատունը և մոլային զանգվածը M: R հաստատունը kB-ով կապված է հավասարությամբ.
kB=R/NA.
M-ի արժեքը սահմանվում է հետևյալ կերպ.
M=mNA.
Հաշվի առնելով երկու հավասարությունները՝ մենք ստանում ենք հետևյալ արտահայտությունը մոլեկուլների արմատ-միջին քառակուսի արագության համար.
v=√(3RT/M).
Այսպիսով, գազի մասնիկների միջին քառակուսի արագությունը ուղիղ համեմատական է բացարձակ ջերմաստիճանի քառակուսի արմատին և հակադարձ համեմատական է մոլային զանգվածի քառակուսի արմատին:
Խնդիրների լուծման օրինակ
Բոլորը գիտեն, որ օդը, որը մենք շնչում ենք, 99% ազոտ և թթվածին է: Անհրաժեշտ է որոշել N2 և O2 մոլեկուլների միջին արագությունների տարբերությունները 15 o ջերմաստիճանում: C.

Այս խնդիրը կլուծվի հաջորդաբար։ Նախ, մենք ջերմաստիճանը թարգմանում ենք բացարձակ միավորների, ունենք՝
T=273, 15 + 15=288, 15 Կ.
Հիմա գրեք մոլային զանգվածները յուրաքանչյուր դիտարկվող մոլեկուլի համար:
MN2=0,028 կգ/մոլ;
MO2=0,032 կգ/մոլ.
Քանի որ մոլային զանգվածների արժեքները մի փոքր տարբերվում են, նրանց միջին արագությունները նույն ջերմաստիճանում նույնպես պետք է մոտ լինեն: Օգտագործելով v-ի բանաձևը, մենք ստանում ենք հետևյալ արժեքները ազոտի և թթվածնի մոլեկուլների համար՝
v (N2)=√(38, 314288, 15/0, 028)=506,6 մ/վ;
v (O2)=√(38, 314288, 15/0, 032)=473,9 մ/վ:
Քանի որ ազոտի մոլեկուլները մի փոքր ավելի թեթև են, քան թթվածնի մոլեկուլները, դրանք ավելի արագ են շարժվում: Միջին արագության տարբերությունը՝
v (N2) - v (O2)=506,6 - 473,9=32,7 մ/վ:
Ստացված արժեքը ազոտի մոլեկուլների միջին արագության ընդամենը 6,5%-ն է։ Մենք ուշադրություն ենք հրավիրում գազերում մոլեկուլների բարձր արագությունների վրա, նույնիսկ ցածր ջերմաստիճաններում:






